- Nature Catalysis 3월호 표지 논문에 선정 -
국내 연구진은 친환경적인 방법으로 수소기체를 얻을 수 있는 물 전기분해(수전해) 촉매를 개발하여 Nature 자매지인 Nature Catalysis 3월호 표지 논문으로 발표하였음. 물 전기분해를 통한 수소생산은 수소경제를 완성하기 위하여 필수적이기 때문에 중요성이 높음. 서울대학교 화학부 임종우 교수 연구팀 (제1저자 Jian Wang박사)과 한국과학연구원 화학과 김형준 교수 연구팀은 이차전지 양극소재인 리튬 코발트 산화물(LiCoO2)에 염화이온(Cl-)을 미세하게 도핑하는 방법으로 경제성, 효율성, 수명을 현저히 향상시킨 물 전기분해 양(+)극 촉매를 개발하였음.
기존 물 전기분해 (+)양극 촉매로 사용되는 루테늄산화물(RuO2)은 매우 고가이며 물 전기분해 도중 수명이 급격히 떨어지는 문제가 있음. 이를 해결하기 위해 경제적인 전이금속산화물 등(코발트,니켈,철,망간 등)을 촉매로 대체하여야 함. 리튬전지 양극소재로 널리 사용되는 리튬 코발트 산화물(LiCoO2)또한 물 전기분해 양(+)극 촉매로 사용하고자 하는 시도가 있어 왔지만 큰 소득을 얻을 수 없었음. 본 연구를 통해 기존 이차전지 활물질 대량생산 인프라를 활용할 수 있는 가능성이 열렸기 때문에 파급력이 높을 것으로 기대됨.
기존 전이금속산화물은 물 전기분해반응 도중 촉매구조가 변하는 상변이 (phase transformation) 현상에 의해 촉매가 망가지거나 성능이 저하되는 고질적인 문제를 안고 있음. 본 연구는 물 전기분해 중에 리튬 코발트 산화물의 상변이를 유도하여 촉매 성능이 오히려 높이는 방법을 찾아냈음.
충방전 도중 리튬 코발트 산화물내 리튬이 물질내로 자유롭게 들어갔다 나올 수 있다는 사실에 착안하여 연구를 시작함. 물 전기분해 반응 중 빠져나가는 리튬의 이동을 제어함으로써 촉매 상변이를 조절할 수 있을 것이라는 가설에서 시작됨.
여러 노력끝에, O2-이온을 Cl-이온으로 치환할 경우(Co의 산화수가 3+에서 2+로 낮춰짐) 물 전기분해 도중 표면의 리튬 이동량이 현저히 많아지면서 전해질로 빠져나가는 것을 발견하였음. 그리고 리튬 코발트 산화물 표면에 새로운 상변이 현상이 일어나는 것을 발견함. 그 결과 그리고 전기분해 반응 효율과 수명이 월등히 상승한 것을 확인하였음.
그 이후, 연구진은 오랜시간 그 원리를 검증하려는 연구를 진행하였음. 특히, 물 전기화학 반응도중 리튬 코발트 산화물의 리튬이 수월히 빠져나가면서 상변이가 일어나는 메커니즘을 설명할 증거가 필요하였음. 이를 위하여 국내 포항방사광가속기 연구소와 해외 유수 방사광가속기의 X선 흡광, 회절, 산란실험 등을 수행하였음. 특히 포항방사광가속기 김민규 박사 연구팀과 수행한 실시간 X선 흡광 실험을 통하여 리튬 코발트 산화물의 전자구조, 결정구조가 물 전기분해도중 가설대로 변한다는 결정적인 증거를 찾아낼 수 있었음.
한국과학기술원의 김형준 교수 연구팀은 실험적 결과를 양자계산을 통하여 이론적 해석을 맡았음. Cl-이온이 리튬 코발트 산화물내 전자구조에 미치는 영향을 이론적으로 해석하였음. 그리고 물 전기분해 도중 리튬이 쉽게 빠져나가고 수산화코발트 상으로 유도할 수 있음을 이론적으로 정립하였음.
본 연구 제1저자인 서울대 Jian Wang 박사는 홍콩과학기술대에서 박사학위를 받고 서울대 임종우 교수 연구실에 2018년에 박사후 연구원으로 합류한 해외 인재임. 서울대가 해외 우수 신진 박사급 인력을 적극적으로 양성하기 위해 설립한 SNU Science Fellow에 선정되어 본 연구를 수행하였음. 본 연구에 참여한 로렌스 버클리 국립연구소, 중국 북경대, 홍콩과기대 등 해외 우수 연구팀 중심에서 국내 연구진이 주도한 연구 성과라는 점에서 의미를 가짐.
한편 이번 연구는 연구재단의 기후변화대응기술개발사업, 수소에너지혁신기술개발사업, 신진연구자지원사업, 미래소재디스커버리사업 및 삼성전자 미래기술육성센터의 지원을 받아 수행되었다.
[연구결과]
Redirecting Dynamic Surface Restructuring of a Layered Transition Metal Oxide Catalyst for Superior Water Oxidation
Jian Wang, Se-Jun Kim,D Jiapeng Liu, Yang Gao, Subin Choi, Jeongwoo Han, Hyeyoung Shin, Sugeun Jo, Juwon Kim, Francesco Ciucci, Hwiho Kim, Qingtian Li, Wanli Yang, Xia Long, Shihe Yang, Sung-Pyo Cho, Keun Hwa Chae, Min Gyu Kim, Hyungjun Kim,D, Jongwoo Lim
(Nature Catalysis in press)
물을 분해하여 수소를 발생시킬 수 있는 물 전기분해반응의 양극 촉매의 고질적인 문제를 해결하고 새로운 방향을 제시한 연구이다. 저가촉매로 각광을 받는 비귀금속 전이금속 산화물 전기촉매는 반응 중 촉매 표면이 망가지기 때문에 효율과 수명이 급격히 떨어지는 문제가 있었다. 본 연구진은 이차전지에서 사용되는 LiCoO2소재의 산소이온(O2-)을 염화이온(Cl-)으로 치환하여 전자구조를 제어함으로써 반응중 표면 상변이를 열역학적으로 안정된 방향으로 제어할 수 있다는 것을 증명하였다.
새로 개발된 촉매의 수명과 효율은 기존 귀금속 기반 루테늄산화물 보다 월등히 높다는 점에서 상용화 가능성이 높다. 더불어, 대량생산 설비가 갖추어진 이차전지소재를 수소생산 전기화학반응에 활용할 수 있는 가능성을 보여주었다는 점에서 커다란 잠재력이 있다.
[용어설명]
- ○전압이 가해진 양 전극에서 각각 수소와 산소가 발생시키는 반응을 지칭함. 수소가 발생하는 음극과 산소가 발생하는 양극 모두 효율성이 높아야 물 전기분해 반응의 효율이 상승함.
- ○LiCoO2와 같이 Co, Ni, Mn와 같은 전이금속원소가 산소와 결합하여 합성된 소재를 일컬음.
- ○2019년 노벨화학상을 수상한 John Goodenough교수가 개발한 리튬이차전지 양극소재로, 리튬이온이 소재내 원활히 이동할 수 있도록 설계된 소재임. 스마트폰등 다양한 전자기기의 이차전지에 사용되고 있는 소재임.
- ○소재내 원소를 다른 원소로 미세하게 치환하는 과정을 일컬음.
- ○귀금속인 류테늄의 산화물로서, 물의 전기 분해 반응의 기준 양극으로 활용되고 있음. 높은 가격과 낮은 안정성이 문제되어 상용화에 걸림돌이 되고 있음.
- ○물질의 상이 변하는 과정. 얼음-물-수증기의 변화가 상변이의 대표적인 예시. 탄소로 이루어져있는 흑연과 다이아몬드 또한 다른 상이며, 흑연이 다이아몬드로 변하는 과정을 상변이라고 지칭함.
- ○고체소재 내부 전자가 차지하고 있는 에너지와 위치를 일컬음. 전자제품등에 사용되는 소재의 성질을 결정하는 주요 요소이며, 반도체, 전극촉매, 디스플레이 개발에 필수 결정 요소임.
[그림설명]

-LiCoO2전기촉매 표면을 정밀하게 제어하여 물분해 반응을 유도하는 도식
-Nature Catalysis 3월자 커버로 채택

서울대 연구팀 사진(위 왼쪽부터 김휘호, 조수근, 김주원, 한정우, 최수빈 연구원; 아래 왼쪽부터 임종우 교수, Jian Wang 박사)

a: LiCoO1.8Cl0.2 (보라색) b. LiCoO2 (오렌지색) 의 고분해 전자현미경 사진.
각 원자들이 점들로 이미징됨. Cl 이온이 치환되었기 때문에 LiCoO1.8Cl0.2 의 원자 배열이 LiCoO2에 비해 살짝 틀어진 것을 알 수 있음. Cl이온으로 치환이 잘 되었음을 보여주는 결과임.
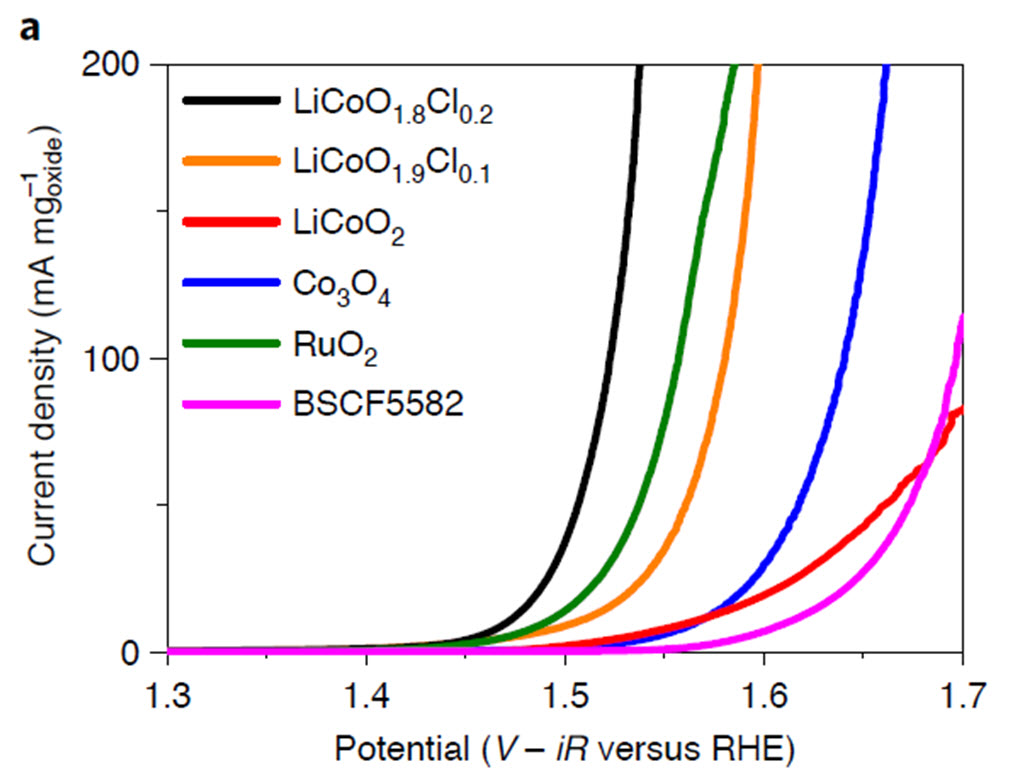
LiCoO1.8Cl0.2 (검은색)의 전류값이 기존 RuO2촉매(녹색)에 비해 더 큰 것을 알 수 있음. LiCoO1.8Cl0.2에 의하여 일어나는 물의 전기분해 속도가 가장 빠른 것을 알 수 있음.
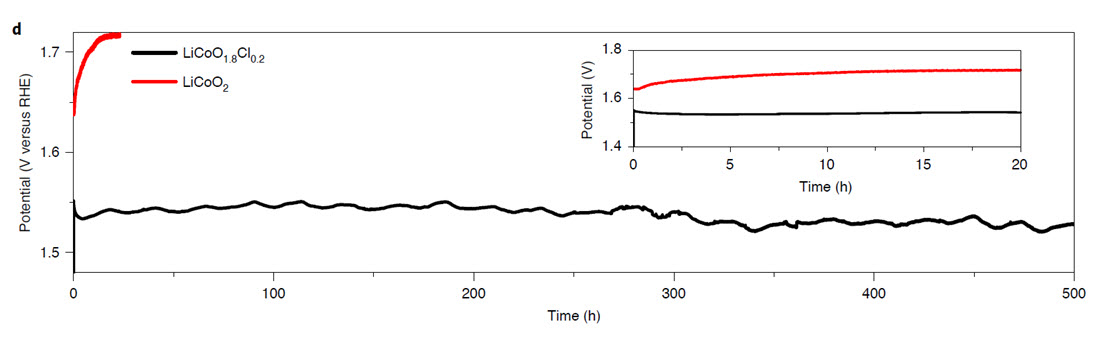
500시간 이상 LiCoO1.8Cl0.2촉매의 수명이 유지되는 것을 보여주는 결과. 그에 비해 LiCoO2 는 시간에 따라 과전압이 많이 걸리는 것으로 관측됨. 수명이 유지되지 못하는 것을 보여줌.

Cl도핑 농도에 따라 물 전기분해 반응 이후 촉매표면의 상변이 형상이 달라지는 것을 보여주는 전자현미경 사진. 물 전기분해 이후에 측정한 (LiCoO2, LiCoO1.9Cl0.1, LiCoO1.8Cl0.2) 전자현미경 사진을 통해, LiCoO2의 표면은 결정성을 유지한 스피넬구조로 상변이 되는 것을 발견함. LiCoO1.8Cl0.2의 표면은 비정질의 CoOOH 코발트 수산화물로 상변이 된 것을 발견함.
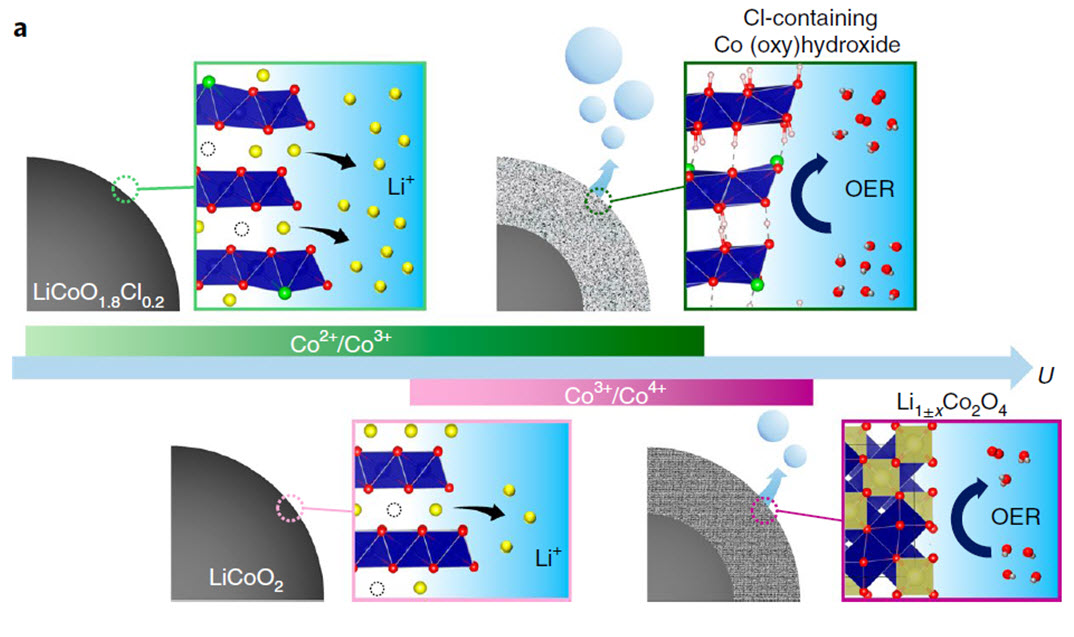
논문 요약 모식도: LiCoO1.8Cl0.2 의 경우 물 전기분해 반응중 표면리튬이 전해질로 많이 빠져나오면서 표면이 코발트 수산화물로 변환되는 것을 유도함. LiCoO2의 경우, 물 전기분해 반응중 표면리튬이 전해질로 거의 빠져나오지 못하기 때문에 표면의 결정구조가 유지된 스피넬구조물로 변환됨.

