개체 수준 단백질 항상성 유지 및 병인단백질 제거의 새로운 기전 제시
[연구필요성]
단백질 항상성(protein homeostasis)은 세포의 정상적인 기능 유지에 꼭 필요한 생화학적 조절기전이다. 이 과정의 문제로 야기되는 병인단백질의 불균형은 암, 대사질환, 퇴행성 뇌질환 등과 밀접한 관계를 가지고 있다.
세포 내 단백질 대부분을 분해한다고 알려진 프로테아좀(proteasome)은 단백질 항상성 유지에 핵심 역할을 하고 있다. 그러나, 이 효소가 세포 밖에서도 존재하는지, 그렇다면 어떤 역할을 하는지, 어디에서 유래하는지 등은 알려져 있지 않다.
또한, 단백질의 생성과 분해는 지금까지 세포 안에서만 연구가 이뤄져 왔다. 단백질 항상성과 관련된 핵심 인자들이 세포 간에 어떻게 전달되고, 이것이 몸 전체에서 어떤 영향을 미치는지는 거의 연구가 이뤄지지 않은 상황이다.
세포밖 소포체(EV, extracellular vesicle)는 세포가 만들어내는 아주 작은(나노미터 크기)의 이동성 주머니로, 세포 내부 물질을 외부로 전달하는 역할을 한다. 하지만, EV가 수송하는 내용물이 실제로 다른 세포 내에서 어떤 기능을 하는지는 아직 명확하지 않다.
[연구성과/기대효과]
이번 연구에서 세포 안의 프로테아좀이 EV에 실려 세포 밖으로 분비되고, 궁극적으로 다른 세포로 전파될 수 있음을 세계 최초로 밝혀냈다.
특히 EV를 통해 수송되는 프로테아좀은 일반적인 형태(26S)가 아니라 더 단순한 20S의 형태였으며, 이는 에너지가 부족한 세포 바깥 환경에서도 효율적으로 작동하기 위한 방식으로 보인다.
이렇게 전달된 프로테아좀은 수용 세포 안에서 단백질을 정상적으로 분해하며, 특히 과도하게 존재하고 있는 병인단백질(예: 알츠하이머병의 응집성 병인단백질 타우, tau)의 분해를 촉진시킬 수 있음이 확인되었다.
이과 같은 결과들은, 1) 세포 간에도 단백질 품질을 관리하는 네트워크가 존재함을 세계 최초로 제시하였고, 2) EV를 활용하여 난치성 질환의 치료에 응용할 수 있는 가능성을 제시하였다.
후속연구를 통하여, EV를 보다 정밀하게 정제하고, 프로테아좀을 안정적으로 탑제하는 기술이 개발된다면, 이를 기반으로 한 새로운 개념의 약물전달 시스템으로 활용될 수 있을 것으로 기대된다.
[본문]
서울대학교 의과대학 이민재 교수 연구팀은 세포 안에서 단백질을 분해하는 핵심 효소인 '프로테아좀(proteasome)'이 세포밖 소포체(EV, extracellular vesicle)에 실려 세포 밖으로 분비되고, 이들이 다른 세포로 전파되어 병인단백질을 제거하는데 기여한다는 사실을 밝혀내었다.
이처럼 세포 안에 있는 프로테아좀이 EV라는 작은 주머니에 담겨 세포 밖으로 분비, 전달되는 현상은, 지금까지 잘 알려지지 않았던 새로운 생리현상으로, 세포 간 단백질 품질 관리와 개체(organism) 수준 항상성 유지에 중요한 역할을 할 수 있음을 보여준다.
연구진은 특히, EV를 통해 세포 밖으로 수송되는 프로테아좀이 일반적으로 알려진 “26S” 프로테아좀 전효소가 아니라, 더 단순한“20S” 프로테아좀 형태임을 규명하였다. 이는 세포 내부처럼 에너지가 풍부한 환경에서 벗어나 에너지가 부족한 세포 외부 환경에서도 단백질 분해 기능을 유지하기 위한 개체의 생화학적 적응 기전으로 해석된다.
연구진은 인간 세포주에서 분리/정제한 EV가 실제로 다른 세포로 20S 프로테아좀을 효율적으로 전파할 수 있음을 확인하였다.
전달된 20S 프로테아좀은 수용 세포 안에서도 단백질 분해효소로서의 기능을 정상적으로 수행했으며, 특히 과도하게 축적된 병인단백질(예: 알츠하이머병에서 비정상적으로 응집/축적되는 타우, tau)을 선택적으로 분해하는데 도움을 주는 것으로 나타났다. 이 과정에서 정상적인 세포 기능에는 큰 영향을 주지 않았다.
본 연구에서는 1) 프로테아좀이 단지 세포 안에서만 작동하는 것이 아니라 EV를 통해 다른 세포로 전달되며, 2) 개체 차원에서 단백질 항상성을 조절하고, 병의 원인이 되는 단백질을 제거하는 데까지 역할을 확장할 수 있다는 새로운 생물학적 패러다임을 제시하고 있다.
또한, 이러한 발견은 향후 EV를 활용한 약물전달 시스템 개발에도 큰 도움을 줄 수 있으며, 알츠하이머병 등 단백질의 이상적 축적으로 인해 발생하는 다양한 질병에 대한 혁신적인 치료 전략을 마련하는 데에도 중요한 발판이 될 것으로 기대된다.
본 연구결과는 국제 학술지 Journal of Extracellular Vesicles (IF 16.0)에 2025년 5월 19일자로 게재되었다.
[연구결과]
Extracellular Vesicle-Mediated Delivery of 20S Proteasomes Enhances Tau Degradation in Recipient Cells
Jiseong Kim, Yuping Zhao, Hyun Young Kim, Sumin Kim, Yanxialei Jiang, Min Jae Lee
(Journal of Extracellular Vesicles, https://doi.org/10.1002/jev2.70086)
본 연구는 세포밖 소포체(EV)를 통한 프로테아좀의 세포 간 전달 메커니즘을 세계 최초로 규명하였다. 이를 통해 개체 차원에서 이루어지는 단백질 항상성 유지 및 병인단백질 제거 기전에 대한 새로운 가능성을 제시하였고, EV를 활용하는 새로운 약물전달 시스템 및 치료 전략의 개발에도 중요한 학문적 단서를 제공하였다.
- ○프로테아좀(Proteasome) : 세포 내에서 불필요하거나 손상된 단백질의 대부분을 분해하는 단백질 분해효소. 주로 유비퀴틴화된 단백질의 분해에 관여하고 있음.
- ○세포밖 소포체(Extracellular Vesicle, EV) : 세포가 분비하는 소형 막 구조로, 단백질, RNA 등 다양한 생체분자를 포함하여 세포 간 신호 전달에 관여함.
[그림설명]
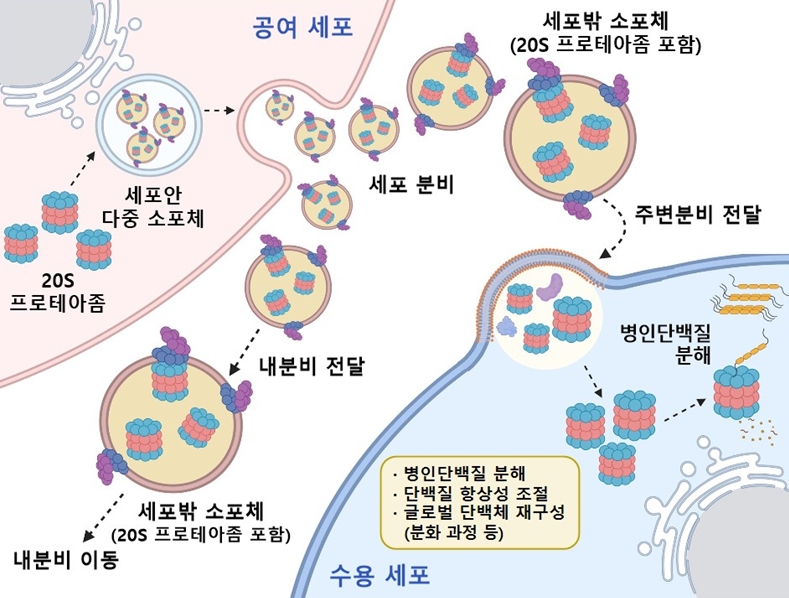
세포밖 소포체를 통해 분비 및 이동되는 프로테아좀



