세포 사멸을 막아 항암제 효과를 떨어뜨리는 숨은 물질, 제거하면 치료 성과 향상돼
[연구필요성]
세포 사멸은 조직 내 항상성을 유지하고 체내 염증반응을 조절하는 핵심적인 면역학적 과정으로 암세포의 비정상적인 증식을 억제하는 데 중요한 역할을 한다. 최근 이러한 세포 사멸 과정이 체내 다양한 대사산물의 영향을 받는다는 사실이 밝혀지며 주목받고 있다. 항암 치료에 사용되는 화학요법 약물의 대사가 이러한 세포 사멸에 미치는 영향 및 그 구체적인 기전에 대해서는 알려진 것이 많지 않아 더 심층적인 연구가 필요한 상황이다.
[연구성과/기대효과]
연구팀은 폴리아민 대사를 통해 생성되는 대사산물‘아크롤레인’이 염증성 세포 사멸 기전 중 하나인‘페롭토시스’를 유도함과 동시에 다른 사멸 기전인‘네크롭토시스’를 억제하는 두 상반된 역할을 한다는 사실을 규명하였다. 아크롤레인은 네크롭토시스를 유도하는 주요 분자인 MLKL의 중합을 저해함으로써 세포 사멸을 억제하였다. 연구팀은 마우스 모델을 통해 널리 쓰이는 항암제인 사이클로포스파아미드로부터 부산물로 생성되는 아크롤레인이 항암 효과를 저해한다는 것을 밝혔다. 이는 아크롤레인 포획제의 병용 투여를 통해 항암 화학 요법의 효능을 강화시킬 수 있음을 시사하며, 세포 사멸과 대사 간 상호작용 연구의 중요성 및 활용 가능성을 보여준다.
[본문]
암을 치료하기 위해 쓰이는 약물 속에, 오히려 암세포 제거를 방해하는 물질이 숨어 있다면 어떨까? 서울대학교 연구팀이 바로 그 실체를 밝혀냈다. 27일 국제학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’에 소개된 연구에 따르면, 항암 치료 과정에서 생성되는 독성 대사산물 ‘아크롤레인’이 세포의 사멸을 억제하면서 치료 효과를 떨어뜨리는 것으로 나타났다. 이 물질은 암세포를 제거하는 데 중요한 역할을 하는‘네크롭토시스’라는 세포 사멸 경로를 방해하며, 암의 저항성을 높이는 데 기여한다. 연구팀은 이 아크롤레인을 제거했을 때 항암제가 더 효과적으로 작용한다는 사실을 확인했고, 이를 통해 새로운 치료 전략의 가능성도 제시했다.
과거에는 세포막 무결성이 보존되는 세포 사멸인 “아폽토시스”만이 조절된 사멸 기작으로 여겨졌다. 그러나 “네크롭토시스”나 “파이롭토시스”와 같이 세포막 무결성을 의도적으로 손상하는 조절된 사멸 기작이 발견된 후, 면역학적 맥락에서 이러한 사멸 기작들의 역할과 의미가 주목받게 되었다. 막 무결성 손상은 세포 내용물의 유출로 이어지고 이는 면역세포를 자극하여 염증반응을 촉진하기 때문이다. 따라서 세포 사멸의 메커니즘을 이해하고 그 경로를 조절하는 것은 면역 기전 연구나 암 치료 맥락에서 큰 의미를 가진다.
조절되지 않는 세포 사멸은 통제되지 않는 세포 증식으로 이어지는 암의 특징이다. 항암 치료는 기본적으로 암세포의 사멸 목적으로 시행하는 다양한 의료적 개입을 통하여 이루어진다. 다양한 사멸 기작이 밝혀짐에 따라 기존 항암치료에 대하여 저항성을 가지는 이유를 설명할 수 있게 되었다. “네크롭토시스”는 “아폽토시스”에 저항하는 암세포 조직을 제거하기 위하여 대안적으로 표적화할 수 있는 사멸경로이다. 기본적으로 암세포를 제거하는 데 기여하고, 막 무결성 손실 및 세포 내용물 유출을 통하여 항종양 면역을 촉발 및 증폭시킬 수 있다. 연구팀은 폴리아민 대사, 담배 연기 또는 연료 연소에서 유래하는 대사 부산물인 아크롤레인이“네크롭토시스” 실행 분자인 MLKL의 올리고머화를 억제함으로써 암세포 사멸을 억제함을 보고하였다.
마우스에 대사적으로 아크롤레인을 생성하는 항암제인 사이클로포스파아미드를 투여하면 아크롤레인의 “네크롭토시스”를 억제 효과로 인하여 항암제 효능을 감소시킨다. 연구팀은 아크롤레인 포획제인 하이드랄라진을 사용하였을 때 치료 효능이 향상됨을 보여 대사 부산물을 제거하면 특정 항암 화학 요법의 성공 가능성이 높아진다는 것을 보여주었다. 본 연구를 주도한 서울대학교 라젠드라 카르키 교수는 “독성 대사산물이 전혀 예상하지 못하는 경로를 통하여 은밀하게 암 치료를 방해할 수 있으며 이를 표적화하는 새로운 치료 전략을 개발할 수 있을 것”이라고 말했다.
아크롤레인은 비단 항암제 뿐만이 아니라 포유류 세포에 풍부하게 존재하는 천연 폴리아민인 스퍼민, 스페르미딘의 이화작용으로부터도 유래한다. 연구팀은 폴리아민 이화작용의 중심 효소인 SAT1의 결손이 “네크롭토시스”를 증가시킨다는 것을 입증하였으며 세포 내 폴리아민 대사 또한 아크롤레인을 통하여 간접적으로 세포 사멸에 영향을 미칠 수 있음을 밝혔다. 본 성과는 대사와 세포 사멸 간 상호작용의 한 사례를 보여줌으로써 대사적 개입을 통한 암 치료법 개선의 토대를 마련하였다는 의미를 가진다.
[연구결과]
Ferroptosis-activating metabolite acrolein antagonizes necroptosis and anti-cancer therapeutics
Hyun Bae, Seonghyun Moon, Mengmeng Chang, Fenfen Zhang, Yeonseo Jang, Wonyoung Kim, Soyeon Kim, Minjie Fu, Jaemin Lim, Seongjun Park, Chirag N. Patel, Raghvendra Mall, Min Zheng, Si Ming Man, Rajendra Karki
(Nature Communications, https://doi.org/10.1038/s41467-025-60226-1)
항암 화학요법은 암세포를 사멸시키는 것을 목표로 하지만, 이 과정은 대사 부산물에 의해 방해받을 수 있다. 이러한 대사산물이 어떻게 항암 치료를 저해하는지는 아직 명확히 밝혀지지 않았다. 본 연구에서는 폴리아민 대사, 담배 연기, 연료 연소 등으로부터 생성되는 대사산물 ‘아크롤레인’이 ‘페롭토시스’를 유도하는 동시에, ‘네크롭토시스’ 실행 단백질인 MLKL의 중합을 억제해 암세포의 사멸을 저해한다는 사실을 규명하였다. 또한, 아크롤레인 생성에 관여하는 효소 SAT1이 결손되면 세포가 네크롭토시스에 더 민감해지는 것으로 나타났다. 마우스 모델에서는 아크롤레인을 포획하는 물질을 함께 투여했을 때 항암제(사이클로포스파아미드)의 치료 효과가 향상되었다. 실제 인간 암 환자에서도 세포 사멸 활성이 높고 폴리아민 대사를 조절하는 유전자 발현이 낮을수록 생존율이 높게 나타났다. 본 연구는 대사 경로의 조절이 특정 항암제의 치료 성공률을 높일 수 있음을 시사한다.
- ○네크롭토시스 (Necroptosis) : 세포 괴사(Necrosis)의 조절되는 형태의 염증성 세포 사멸로, MLKL 분자의 중합 및 막 기공 형성에 의해 매개된다.
- ○폴리아민 (Polyamine) : 두 개 이상의 아민기를 가지고 있는 유기 화합물로, 포유류 세포에는 스퍼민(Spermine), 스퍼미딘(Spermidine) 및 푸트레신(Putrescine)의 세 종류만 존재한다.
[그림설명]
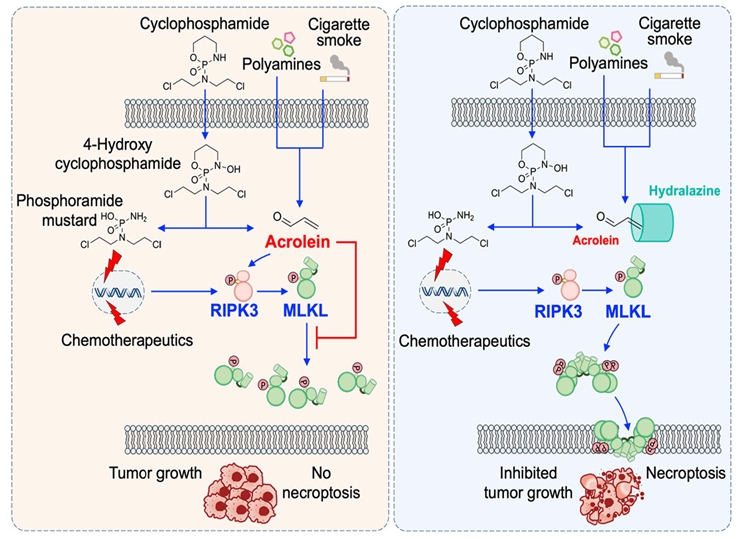
대사 과정 또는 외부에서 유래한 아크롤레인이 네크롭토시스를 억제하고 화학요법에 대한 내성을 유도하는 메커니즘을 도식화한 그림 (Graphical Abstract).



