- 유전자 수준의 생합성 경로 규명으로 신약개발을 위한 천연물 구조 개량 길 열어 -
- ○서울대학교(총장 오세정) 약학대학 제약학과 (천연물과학연구소) 윤여준 교수팀, 오동찬 교수팀 및 이화여자대학교(총장 김은미) 화학나노과학과 차선신 교수팀은 공동연구를 통하여, 해양 미생물의 모듈화된 형태의 거대 非리보좀 펩타이드 합성효소 (nonribosomal peptide synthetase, NRPS)에 의한 WS9326A라는 유용생리활성물질의 생합성이 현재까지 알려지지 않았던 특이 메카니즘에 의해 이뤄진다는 것을 세계 최초로 규명하였다.
- ○이 연구결과는 세계적으로 권위 있는 학술지 중 하나인‘앙게반테 케미 (Angewandte Chemie International Edition, IF 12.959)’에 게재되었다 (논문명: Unprecedented Noncanonical Features of the Nonlinear Nonribosomal Peptide Synthetase Assembly Line for WS9326A Biosynthesis, 공동 제1저자: 서울대 김면수, 배문형, 이화여대 정예은).
- ○일반적으로 생체 내 단백질 등 펩타이드는 리보좀에 의해 만들어진다. 그러나 의약품 등으로 사용되는 유용한 생리활성의 비교적 작은 분자량의 고리형 펩타이드는 리보좀이 아닌 모듈화된 형태의 거대 非리보좀 펩타이드 합성효소 (nonribosomal peptide synthetase, NRPS)에 의해서 생합성된다. 인류 최초의 항생제인 페니실린이 진균의 NRPS에 의해서 만들어지는 가장 대표적인 의약품이며, 그밖에 대표적으로 항생제 (반코마이신), 항암제 (블레오마이신), 면역억제제 (사이클로스포린)와 같은 의약품들이 미생물의 NRPS에 의해 생합성되는 것으로 알려져 있다.
- ○NRPS는 아미노산을 선택하여 활성화하는 도메인 (A domain), 아미노산을 연결하여 펩타이드 결합을 만드는 도메인 (C domain), 합성 중인 펩타이드 사슬을 붙잡고 있는 도메인 (T domain)으로 이루어진 모듈 (module)이 최종 산물인 고리형 펩타이드 구조 내 아미노산의 구성 순서대로 작용하는 것으로 알려져 있다. 즉, NRPS를 구성하는 모듈의 순서와 수가 최종 펩타이드 구조의 아미노산의 순서와 수에 상응하는 것 (colinearity rule)으로 알려져 있다.
- ○WS9326A는 타키키닌 (tachykinin) 수용체에 대한 작용을 통해 천식 증상에 대한 완화효과를 보이며, 세포의 신생혈관 생성을 억제하는 효능을 보이는 것으로 알려져 있다. 본 연구팀은 해양 유래 방선균 스트렙토마이세스 종 SNM55로부터 WS9326A를 생합성하는 NRPS를 암호화하는 유전자 집단을 확인하였으며 지금까지의 전형적인 NRPS와는 매우 다른 도메인과 모듈구조로 구성된 것을 발견하였다. 특히, 위치특이적 돌연변이를 통한 NRPS 도메인 활성제거, 각 NRPS 단백질간의 상호작용 특이성 규명, 및 주요 단백질의 3차원 결정구조 규명 등을 통하여, 이 비정형 NRPS가 지금까지 알려진 작동 원리를 따르지 않고, 특정 모듈들은 반복 사용되거나 또는 사용되지 않으며, 독립적으로 존재하는 도메인과 모듈들이 일반적인 펩타이드 형성과정과는 전혀 다른 방법을 통해 아미노산을 활성화하고 이를 펩타이드로 연결하는 생합성 메카니즘으로 작동하고 있음을 최초로 밝혀내었다 (그림 1).
- ○나아가, 규명한 생합성 메카니즘을 기반으로 NRPS 주요 유전자 서열의 변형을 통하여, 기존에 알려져 있던 NRPS의 작동 원리에 대한 이해만으로는 불가능하였던 WS9326A의 신규유도체 (WS9326I, WS9326J)를 조합생합성적으로 창출할 수 있었다 (그림 4). 이를 통해 환형 WS9326A 유도체의 여섯번째 아미노산 서열인 아스파라진의 존재가 암세포 성장/전이에 필수적인 신생혈관 생성의 억제 효과에 있어 중요하다는 구조-활성 상관관계를 규명하였다 (공저자 서울대학교 약학대학 이상국 교수팀 수행).
- ○WS9326A의 생합성 NRPS 효소는 지금까지 보고된 가장 복잡한 형태의 비선형적 (nonlinear) NRPS 중 하나로, 이처럼 비정형적 양상을 보이는 생합성효소에 의한 물질 생합성에 대한 구조적, 생화학적, 유전적 정보를 통한 연구와 이해는, 미생물 내 아직 밝혀지지 않은 유용 천연물의 생합성 경로 파악과 생산에 가치 있는 정보를 제공할 수 있다. 또한, 본 연구를 기반으로 구조적으로 복잡한 천연물의 조합생합성(화학적 방법이 아닌 생합성 유전자의 조합에 의한 화학구조의 변형 방법)에 대한 획기적인 전략을 제시하여, 천연물 유래 신약개발의 장애 요소인 물질 구조 개량의 어려움을 극복할 수 있을 것이다. 나아가 유용활성을 지닌 천연물을 조합생합성적으로 효능, 부작용, 물성 측면에서 개량할 수 있는 길을 열어 신규의약품의 개발에 기여할 수 있을 것으로 판단된다.
- ○이번 연구는 해양수산과학기술진흥원 포스트게놈다부처유전체사업, 해양수산부 극지유래생물자원을 활용한 항생제후보물질개발사업과 한국연구재단의 중견연구[후속]사업, 기초연구실사업, 바이오⸱의료 기술개발사업의 지원 하에 수행되었다.
- ○(교신저자) 윤여준, 오동찬, 차선신 교수, (제1저자) 김면수, 배문형 박사, 정예은 박사과정생

[연구결과]
Unprecedented Noncanonical Features of the Nonlinear Nonribosomal Peptide Synthetase Assembly Line for WS9326A Biosynthesis
Myoun-Su Kim, Munhyung Bae, Ye-Eun Jung, Jung Min Kim, Sunghoon Hwang, Myoung Chong Song, Yeon Hee Ban, Eun Seo Bae, Suckchang Hong, Sang Kook Lee, Sun-Shin Cha,* Dong-Chan Oh,* and Yeo Joon Yoon*
(Angewandte Chemie International Edition, https://doi.org/10.1002/anie.202103872)
WS9326A는 스트렙토마이세스 종에서 확인된 NRPS 유래의 유용생리활성물질이다. 구체적이고 합리적인 도메인의 불활성화 및 TE의 전이 실험을 통해, 1) 독립적인 두 A-T 모듈과 A 도메인 없는 C-T 모듈간의 아미노산의 셔틀링 (shuttling)이 타입 II 형태의 두 TE에 의해 수행되는 점, 2) 그 C-T 모듈이 두 번의 사슬 연장을 위해 같은 단백질 내에서도 다른 모듈과는 독립적/반복적으로 작용한다는 점, 3) 사슬 연장은 수행하지 못하지만 전후 모듈간의 펩타이드 사슬의 전달을 위해 C, T 도메인이 요구되는 특이한 모듈 스키핑 (skipping)을 수행한다는 점을 포함하는 해당 생합성 과정의 복잡하고 비정형정인 양상을 확인하였다.
나아가, 정제된 재조합 단백질을 사용한 단백질 간 상호작용력의 분석, 결정화 및 구조분석을 통해 WS9326A의 생합성 경로가 최초로 규명되었다. 이는 향후 NRP 기반 다양한 천연물의 복잡한 생합성 경로 연구와 이를 통한 천연물 유래 신약개발에 기여하는 바가 클 것으로 예상된다.
[용어설명]
- ○항생제, 항암제 등 약리학적 활성을 지닌 천연물의 일종인 非리보좀 펩타이드 (nonribosomal peptide; NRP)의 생합성에 관여하는 효소이며, 효소 시스템의 구성에 따라 분류되어 진다. 일반적인 선형적 (linear) NRPS에 의한 한 개 아미노산의 펩타이드 사슬로의 결합에는 기본적으로 컨덴세이션 (condensation; C), 아데닐레이션 (adenylation; A), 싸이올레이션 (thiolation; T) 도메인들로 구성된 한 개의 모듈 (Module)이 작용한다. A 도메인에 의해 인식되고 활성화된 특정 아미노산은 T 도메인으로 로딩되고, C 도메인에 의한 펩타이드 결합을 통해 앞 모듈에 위치한 펩타이드 사슬에 연결된다. 최종 연결된 올리고펩타이드는 싸이오에스터레이즈 (thioesterase; TE)를 C 말단에 포함하는 마지막 모듈에 의해 고리화 및 방출된다. 펩타이드 사슬의 변형을 위한 에피머라이제이션 (epimerization; E), 메틸레이션 (methylation; MT) 도메인 등이 추가적으로 존재할 수 있다. 비선형적 (nonlinear) NRPS에서는 특정 도메인이 반복적으로 사용될 수 있으며, 전형적 시스템과는 도메인 혹은 모듈 구성에서 차이가 있어 생합성 경로의 예측이 불가능 할 수 있다. 또한, 타입 II TE와 같이 독립형으로 (stand-alone) 존재하여 작동하는 효소들 또한 존재 가능하다.
[그림설명]
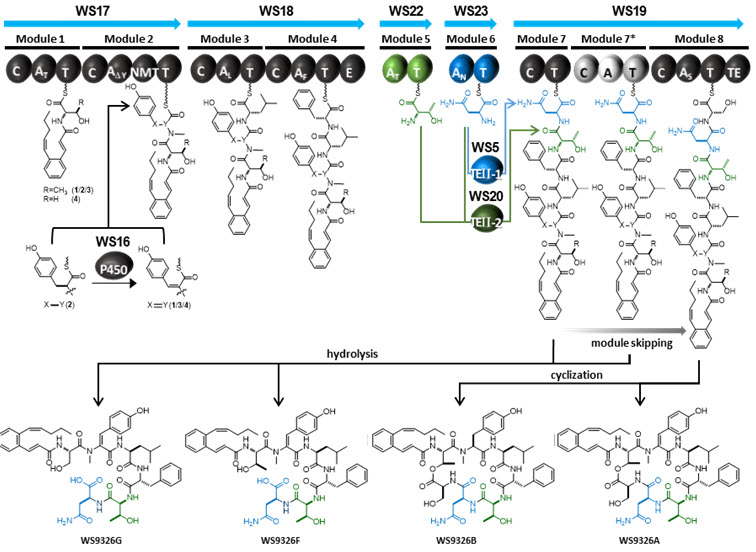
그림 1. 본 연구에서 규명된 WS9326A의 생합성 경로 및 유도체의 구조
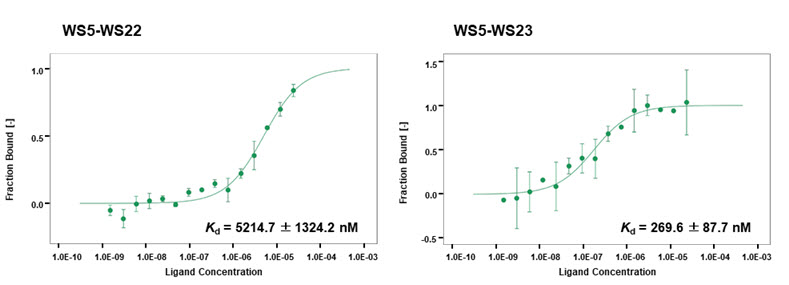
그림 2. 재조합 단백질을 이용한 상호작용 특이성의 분석
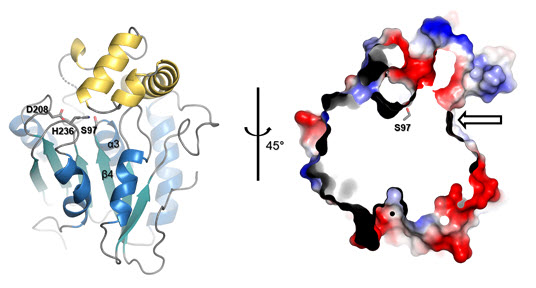
그림 3. 타입 II TE의 3차원 구조
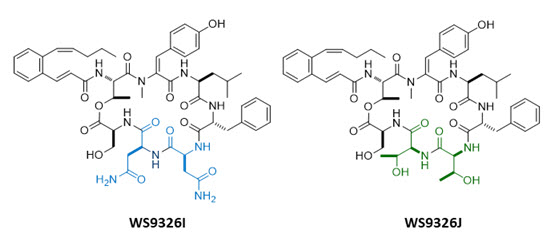
그림 4. 본 연구를 통하여 창출한 신규 천연물의 구조

