- 근접 표지 효소를 활용해 질병 예방 기대 -
서울대학교 화학부 이현우 교수, 한국뇌연구원 문지영 박사 및 서울대학교 생명과학부 김종서 교수 연구팀의 공동 연구팀이 사람의 세포 내에서 RNF5 단백질이 COVID-19 바이러스 단백질을 분해하는 기능을 갖고 있음을 발견했다고 밝혔다.
서울대-한국뇌연구원(KBRI) 공동연구팀은 초분해능 근접표지 기법 (SR-PL)을 활용해 인간세포 내에서 ORF3a (COVID-19의 원인이 되는 SARS-CoV-2 의 단백질 중 하나)과 결합하는 단백질들의 정보를 규명했다. 이 연구를 통해 ORF3a 근처에 존재하는 유비퀴틴 연결 효소 단백질 (RNF5)을 알아내었으며, 스웨덴 카롤린스카 연구소와의 공동연구를 통해 RNF5 단백질 발현 하에 인간 폐 세포에서의 SARS-CoV-2 감염률이 감소한다는 것을 밝혔다. 이러한 바이오틴 표지 기법은 COVID-19를 포함한 여러 질병과 관련된 바이오마커 및 치료 표적 발굴에 적용될 수 있을 것으로 기대된다.
이윤빈 석박통합과정 대학원생(서울대 화학부)이 제1저자로 참여한 이번 연구는 Cell Press 저널인 `셀 레포츠(Cell Reports)' 7월 20일(목)자 온라인 판에 출판됐다. (논문명: Super-resolution proximity labeling reveals antiviral protein network and its structural changes against SARS-CoV-2 viral proteins).
SARS-CoV-2의 액세서리 단백질들은 대부분 숙주 세포 내 소포체로 위치한다고 알려져 있다. 소포체는 단백질 생성에서 중요한 역할을 하여 여러 생물학적 경로를 조절하기 때문에 바이러스가 이러한 소포체를 이용하여 바이러스를 복제 및 분비하고자 한다. 공동연구팀은 이 바이러스 액세서리 단백질들 중에 ORF3a 단백질을 과발현하였을 때 소포체가 바이러스 번식에 유리한 구조로 변형된다는 사실을 전자현미경 사진을 통해 알아낼 수 있었다.
이후에 공동 연구팀은 근접표지 효소를 활용해 COVID 바이러스 단백질인 ORF3a를 살아있는 세포내에 발현시킨 후, 이 단백질과 결합하는 주변 단백질들을 바이오틴으로 표지하였다. 이후에 바이오틴 표지가 된 펩타이드만을 질량 분석하는 “고분해능 근접분자 표지기법 (Super-resolution Proximity Labeling, SR-PL)”을 적용하여 ORF3a와 결합하는 인간 단백질들의 정보를 알아낼 수 있었다.
이 방법을 통해 소포체의 막단백질인 유비퀴틴 연결 효소(RNF5)가 강하게 ORF3a 근처에 위치함을 발견할 수 있었다. 유비퀴틴 연결 효소는 다른 단백질들을 유비퀴틴 표지하여 결국 단백질 분해를 시키는 역할을 한다고 알려져 있기 때문에 RNF5는 ORF3a를 유비퀴틴 표지하며 ORF3a를 분해하는 항바이러스 기능을 수행할 수 있음을 시사한다.
이러한 가능성을 실험으로 확인하기 위해 공동연구팀은 스웨덴 카롤링스카 연구소 소속 바이러스 연구팀 (담당: Anna Smed-Sörensen 교수, Jonas Klingström 교수)과의 공동 연구를 수행하여 RNF5을 인간 폐 세포에 발현시켰을 때, SARS-CoV-2 감염률이 현저하게 감소되는 동시에 ORF3a 발현 정도가 급격하게 줄어드는 것을 확인하였다.
공동연구팀은 이 결과를 바탕으로 RNF5의 기능을 활성화시키는 것이 치료방법이 COVID-19 예방과 치료에 기여할 수 있을 것으로 예상했다.
제1저자인 이윤빈 연구원은“SARS-CoV-2의 액세서리 단백질인 ORF3a은 인간 세포의 소포체에 달라붙어 바이러스 번식에 유리하게 소포체를 변형시킴을 알 수 있었고 또한 동시에 인간단백질인 RNF5는 소포체에서 ORF3a를 적극적으로 분해하며 세포를 지키는 방어기작을 하는 것을 보면서 바이러스와 숙주 단백질들 간의 치열한 다툼이 소포체 막에서 일어남을 알 수 있었다.”라며“인간세포의 소포체에 위치하는 RNF5을 활성화시키는 치료방법의 개발은 효과적인 바이러스 감염 대응 방법이 될 수 있을것 ”이라고 말했다.
이번 연구에서 서울대학교 화학부 이현우 교수 연구실에서는 근접분자 표지효소를 이용한 결한단백질체 바이오틴 표지, 한국뇌연구원 문지영 박사연구실에서는 바이러스 단백질 발현에 의한 소포체 구조 변형 관찰, 서울대학교 생명과학부 김종서 교수연구실에서는 근접분자 표지효소에 의해 바이오틴 표지된 결합단백질체 펩타이드 질량분석 실험을 진행하였으며, 한국연구재단, 한국뇌연구원, 기초과학연구원, 삼성미래기술육성사업의 지원을 받아 수행됐다.
[연구결과]
1. 연구 배경
COVID-19를 야기하는 SARS-CoV-2의 생리학적, 병태생리학적 과정을 규명하는 것이 중요해졌다. SARS-CoV-2는 여러 바이러스 단백질들을 인코딩한다고 알려져 있는데, 그 중 액세서리 단백질들이 숙주 세포 내 소포체로 위치한다고 알려져 있다. 기존의 상호작용 단백질 연구는 세포를 용해한 상태에서 스트렙타비딘으로 당겨 분석하는 것이지만, 이 방법은 살아 있는 세포 내 생리학적 환경을 충분히 반영하지 못한다는 한계가 잘 알려져 있다. 이를 극복하기 위해 본 연구팀은 바이오틴 표지된 펩타이드만 질량 분석하는 방법을 개발하였다. 이러한 방법을 적용하여 SARS-CoV-2 바이러스 단백질의 상호작용 단백질 연구를 보다 더 생리학적 환경을 반영하는 방향으로 실행하였다.
2. 연구 내용
근접 표지 효소인 APEX 와 TurboID는 근접한 단백질에 바이오틴을 표지할 수 있고, 표지된 단백질은 스트렙타비딘(Streptavidin)을 이용해 손쉽게 분리할 수 있다. 먼저 본 연구팀은 APEX를 이용하여 SARS-CoV-2 바이러스 단백질 중 두 개 (ORF3a 와 M 단백질)을 선택하여 어떠한 형태로 소포체를 망가뜨리는지 전자 현미경을 이용하여 관찰하였다. 이후, 인간 배아 신장 세포 내에 ORF3a 와 M 단백질을 TurboID와 함께 발현시켜 어떠한 소포체 단백질들과 상호작용하는지 규명해내었다. 소포체에 위치하는 단백질 중 유비퀴틴 연결 효소 (RNF5)를 ORF3a의 상호작용 단백질로 검출할 수 있었다. 이러한 RNF5가 ORF3a를 기질로 삼아 유비퀴틴 표지한다는 것을 알아내었다. 나아가, 본 연구팀은 RNF5을 인간 폐 세포에 발현시켜 실제로 SARS-CoV-2 감염 상황에서 어떠한 결과를 야기하는지 확인해 보았다. 대조군 세포와 RNF5가 발현한 세포를 비교해 보았을 때, SARS-CoV-2 감염률이 RNF5 발현 하에 현저하게 줄어드는 것을 알 수 있었다. 즉, 본 연구실에서 개발한 상호작용 단백질 연구 기법이 바이러스의 숙주세포내 단백질 결합 네트워크 및 생활사를 연구하는 데에서도 성공적으로 적용될 수 있음을 보여주었다.
3. 기대 효과
본 연구팀은 근접 표지 효소를 이용해 SARS-CoV-2 바이러스의 ORF3a 단백질이 소포체에 위치하며, 소포체의 형태를 바이러스 번식에 유리한 구조로 변형시키는 기능을 갖고 있음을 알아내었으며, 이 바이러스 단백질을 분해하여 COVID-19 감염을 효과적으로 낮출 수 있는 인간단백질인 RNF5 의 항바이러스 기능도 알아낼 수 있었다. 이 연구결과는 RNF5의 기능을 활성화시킬 수 있는 약물 개발은 향후 SARS-CoV-2 바이러스 및 바이러스 변종의 감염에 대응할 수 있는 효과적인 항바이러스 제재가 될 수 있음을 시사한다.
[그림설명]
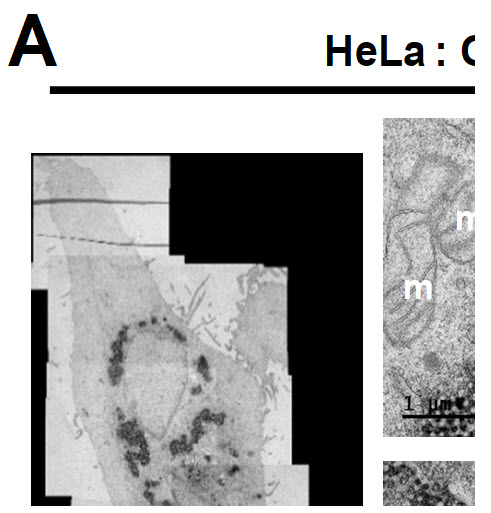
그림 1. 인간세포 내 SARS-CoV-2 단백질인 ORF3a 와 Membrane 발현시켜 소포체가 변형된 결과
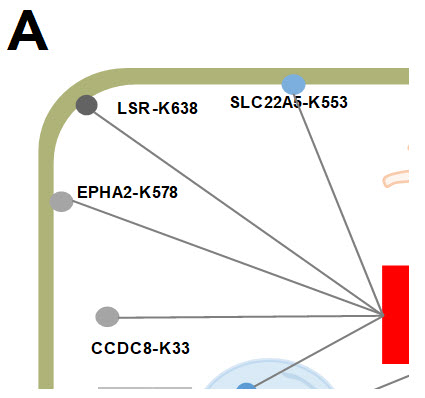
그림 2. 초분해능 근접분자 표지기술을 이용하여 얻은 ORF3a와 M 바이러스 단백질에 결합하는 인간 단백질체 정보
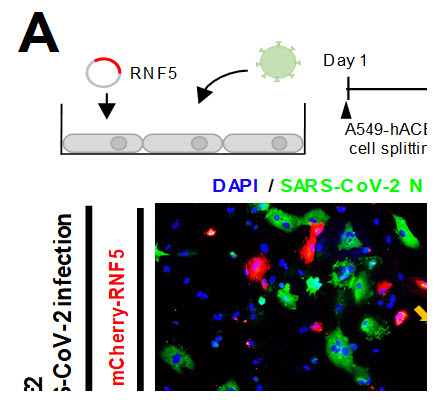
그림 3. 인간 폐 세포 내 RNF5를 발현시킨 결과 SARS-CoV-2 감염률이 줄어드는 결과

