- 병인 단백질‘타우’의 신경독성 물질 형성 및 병리 현상 유발 원리 밝혀 -
[연구필요성]
보건의료 기술의 발전으로 고령화 인구가 늘어나게 되었고, 이에 치매와 같은 퇴행성 신경질환의 환자가 전 세계적으로 늘어나고 있다. 특히 우리나라는 초고령 사회로의 전환속도가 매우 빨라, 치매로 인한 사회경제적 부담이 급증하고 있다. 이에 따라 관련 질환들의 대응과 해결을 위한 적극적인 연구와 치료 기술 개발의 중요성이 대두되고 있다.
가장 흔하게 발생하는 치매의 유형인 알츠하이머병은‘타우’와‘아밀로이드 베타’단백질 등이 응집 및 섬유화되어 신경독성의 원인이 된다고 알려져 있으나, 보다 근본적인 기전은 아직 밝혀지지 않았다. 이러한 병리기전의 부재는 치매 치료제 개발에 한계로 작용하고 있다.
세계보건기구는 전 세계 치매 관리비는 2030년 2조 달러 이상으로 예상하고, 치료제 시장은 200억 달러(약 260조 원) 이상이 될 것으로 추산하고 있다. 기초연구를 통해 발굴된 신규 치료 타겟을 기반으로 한 치매 혁신 신약(first-in-class)은 국가 경제에 큰 기여를 할 수 있을 것으로 기대된다.
[연구성과/기대효과]
본 연구에서는 타우 단백질의 절단을 통하여 생성된 타우 조각이 알츠하이머성 치매 질환의 핵심 병인이라는 가설을 세계 최초로 제시하였다.
타우 조각들의 자발적 응집, 세포 간 전이, 신경세포의 사멸 등의 병리 기전을 다층적으로 검증하여 알츠하이머병의 새로운 발병 모델을 확립할 수 있었다.
해당 연구는 치매 발병 기전에 대한 새로운 패러다임을 제시함으로써, 이에 기반한 혁신적인 치매 치료제 개발의 가능성을 시사하고 있다.
[본문]
서울대학교 의과대학 연구팀이 알츠하이머성 치매의 병인 단백질인‘타우’에 의한 신경독성 물질 형성 원리와 이를 바탕으로 하는 신규 알츠하이머병 발생 기전을 규명하였다.
정상 타우의 내부 절단으로 인하여 생성된‘응집 코어’가 알츠하이머 치매의 핵심 병인이라는 학설을 통해, 새로운 개념의 치매 치료제 개발 가능성을 시사하고 있다.
본 연구는 서울대학교 의과대학 이민재 교수(생화학교실), 서영호 교수(의과학과), 이용석 교수(생리학교실)와 고려대학교 김준곤 교수(화학과) 연구팀 간의 다학제적(생화학, 신경과학, 생물리학 등) 공동연구의 성과이다.
연구팀은 환자 뇌에서 추출한 타우 단백질의 고해상도 구조에 주목하였고, 신경독성 물질 형성을 촉진하는 핵심 영역(응집 코어)에 초점을 맞추어 연구를 시작하였다. 그동안 타우 단백질이 어떻게 섬유화되는지는 아직 규명되지 않았었는데, 연구팀은 이를 분자 수준에서 이해함으로써 알츠하이머병의 발병원인 규명에 조금 더 다가갈 수 있을 것으로 생각하였다.
연구팀은 타우 단백질의 일부분이 별도의 처리 없이 생리적 환경 조건에서 자발적으로 신경 독성물질을 형성할 수 있으며, 정상 타우 단백질까지 신경 독성물질로 전환시킬 수 있는 능력이 있음을 확인하였다. 이는 단백질의 절단으로 특정 부위(응집 코어)가 노출되기 때문이었다.
타우의 절단으로 생성된 신경독성 물질이 신경세포에 침투하는 경로와 추가적인 응집을 유도하는 과정, 그리고, 신경세포의 시냅스 가소성을 떨어뜨리는 현상 등을 규명하여 세포 수준에서 이들의 병리 유도 기전을 확립할 수 있었다.
타우 응집 코어를 생쥐의 뇌실 내 해마에 주입하였을 때, 신경세포 사멸과 신경염증 반응이 일어났고, 기억력 감퇴 등 알츠하이머성 치매와 유사한 행동학적 변화가 일어났다. 이를 통하여, 분자 및 세포 수준에서 규명한 타우 조각의 병리 기전이 동물모델에서도 재현됨을 확인하였다.
연구를 주도한 이민재 교수는 “이 연구는 새로운 타우 단백질의 섬유화 및 신경독성 생성 원리를 분자와 세포, 그리고 동물모델 수준으로 밝혀낸 것”이라며, “후속 연구를 통하여 알츠하이머병의 새로운 치료 방법을 제시하는 데 기여할 것”이라고 연구의 의의를 설명했다.
이민재 교수는 또한“해당 연구는 다양한 분야 연구자들의 협업과 고위험·고수익 기초연구에 대한 국가적 지원을 통해서 비로소 가능해졌다.”라고 하면서 “창의적 R&D 활동에 대한 지속적 지원”의 필요성을 강조하였다.
본 연구는 보건의료 R&D 사업(치매극복연구개발사업)을 통해 지원되었으며, 국제학술지 어드밴스드 사이언스(Advanced Science)에 온라인 게재(2023년 8월 18일)되었다.
[연구결과]
Self-Aggregating Tau Fragments Recapitulate Pathologic Phenotypes and Neurotoxicity of Alzheimer's Disease in Mice
Ly Thi Huong Luu Le, Jeeyoung Lee, Dongjoon Im, Sunha Park, Kyoung-Doo Hwang, Jung Hoon Lee, Yanxialei Jiang, Yong-Seok Lee, Young Ho Suh, Hugh I. Kim, Min Jae Lee
https://onlinelibrary.wiley.com/doi/10.1002/advs.202302035
가장 흔하게 발생하는 치매의 유형인 알츠하이머병은 ‘타우’ 단백질의 응집 및 섬유화가 주원인이라고 알려져 있으나, 보다 근본적인 발병기전은 아직 밝혀지지 않았다. 본 연구에서는 타우 단백질의 절단을 통하여 생성된 타우 조각이 알츠하이머성 치매 질환의 핵심 병인이라는 가설을 세계 최초로 제시하였다. 해당 연구는 치매 발병 기전에 대한 새로운 기초연구적 패러다임을 제시하면서, 이에 기반한 혁신적인 치매 치료제 개발 등의 응용 가능성을 시사하고 있다.
[용어설명]
- ○가장 흔한 치매의 원인이고, ‘타우’ 단백질은 대표적인 병인 단백질로서 알츠하이머 환자의 뇌에서 응집/섬유화되어 비정상적으로 축적됨.
[그림설명]
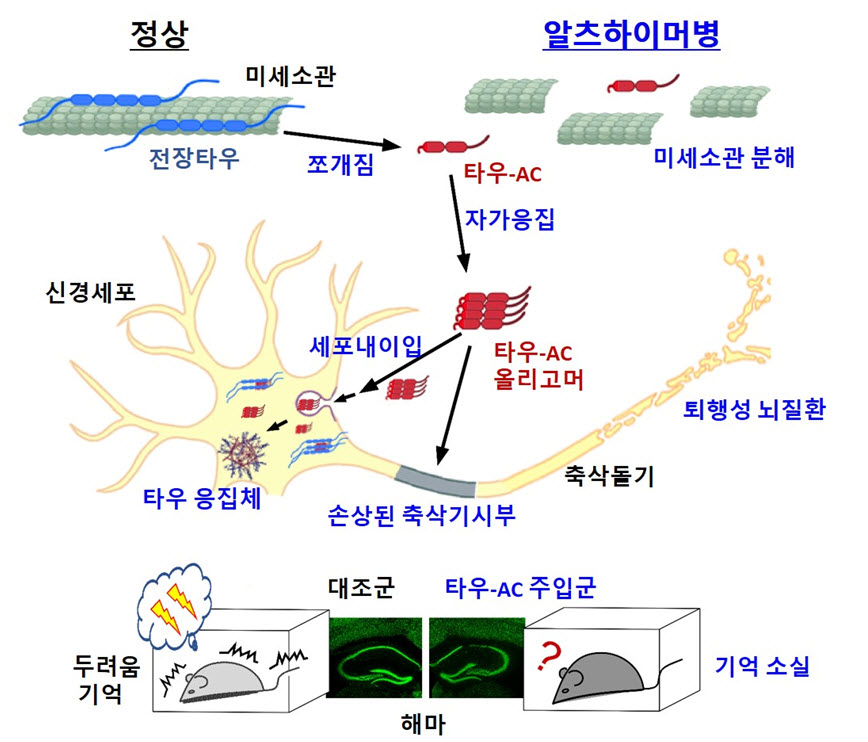
타우 절단으로부터 시작되는 알츠하이머성 치매의 발병 모델
타우 단백질의 내부 절단에 의해 형성된 타우 응집 코어(타우-AC)는 미세소관에서 떨어져 나가 자발적으로 응집된다. 그 결과로 형성된 신경 독성물질은 신경세포 내부로 침투하여, 추가적인 타우의 응집과 축삭기시부(세포체와 축삭의 연결 부위)의 손상, 시냅스 가소성 감퇴 및 신경세포의 사멸을 유도했다. 또한, 타우 응집 코어가 생쥐의 해마에 주입되었을 때, 알츠하이머병의 특색과 유사한 뇌조직의 손상과 기억력 감퇴가 유발되었다. 이러한 결과들은 알츠하이머성 치매의 새로운 분자병인을 제시하는 것으로써, 타우의 섬유화 형성을 억제하기 위한 새로운 치료 방안의 가능성을 시사하는 것이다.

