- 대안적 텔로미어 유지 기전 암의 발생 메커니즘 규명 -
[연구필요성]
염색체 말단의 텔로미어는 세포 분열 과정에서 점차 짧아지는데, 암세포는 극한으로 짧아진 텔로미어를 극복하면서 불멸이 된다. 어떤 세포가 암세포로 변하고, 그 암세포는 어떻게 텔로미어의 길이를 조절할 수 있을까? 약 15%의 암은 텔로머레이즈 없이 텔로미어가 유지되는 대안적 텔로미어 유지 기전 (ALT)을 선택하며, ALT암은 표적 항암제가 존재하지 않으며 예후가 좋지 않다. 어떤 경우에 ALT가 발생할까? 서울대학교 이현숙 교수 연구팀은 텔로미어가 복제될 때 네 가닥 텔로미어 G4 구조의 역동성이 유지되지 못하면 ALT가 발생하며, 이때 ALT 세포의 텔로미어에는 텔로미어 헤테로크로마틴, DNA와 RNA혼성체, TERRA 등 핵산과 거대 단백질 복합체가 밀집하여 마치 물방울과 같은 상분리 기관을 만들어 텔로미어 재조합 (Break-induced Replication)을 유도하여 텔로미어 길이를 유지하면서 암화가 진행된다는 연구결과를 발표하였다. 특히 암억제인자인 BRCA2가 텔로미어 G4의 역동성을 조절하는 핵심 인자라는 점을 밝혀 BRCA2 결손시 텔로미어가 짧아지다가 ALT 암화가 진행되는 원인을 규명하기에 이르렀다. 이 연구는 ALT 암세포의 새로운 타겟으로서 텔로미어 상분리 형성과 유지 기전에 핵심적인 텔로미어 G4 구조 역동성 손실, TERRA-R-loop 이라는 DNA:RNA 혼성체를 타겟하게 되면 상분리가 사라지고 ALT 암을 표적할 수 있다는 데이터를 제시하여 예후가 좋지 않은 ALT 암세포를 표적할 수 있는 길을 열었다. 이 논문은 Nucleic Acids Research (Impact Factor 14.9)에 3월 23일 게재 승인되고 온라인 판으로 발표 되었다.
[연구성과/기대효과]
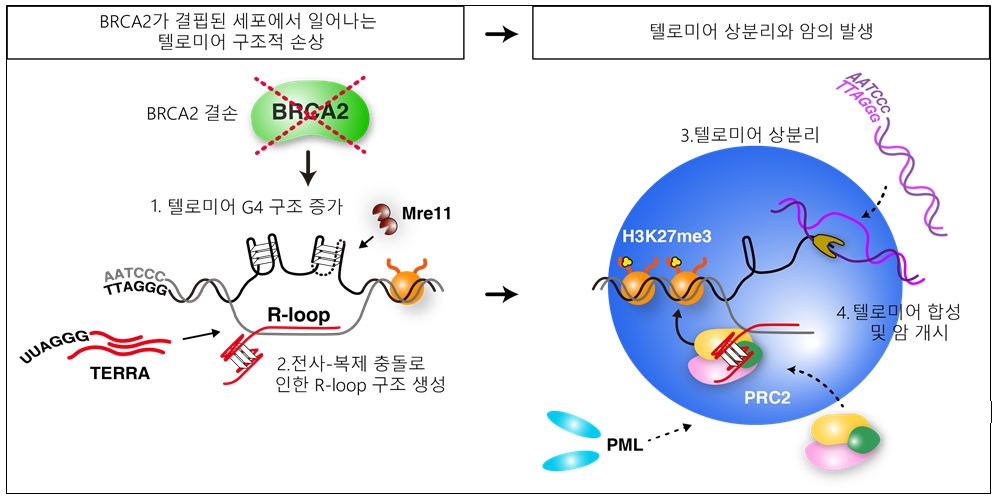
BRCA2 단백질은 텔로미어의 네가닥 특이 구조 (G4)의 역동성을 조절하여 텔로미어를 보호한다. 그러나 BRCA2가 결핍된 세포는 이러한 상호작용이 깨지며 텔로미어에서 비정상적으로 G4 구조가 증가한다. 연구팀은 이렇게 증가한 G4 구조가 어떻게 텔로미어 합성을 유도하여 암을 발생시키는지 분자적 메커니즘을 밝혔다. G4 구조는 두세 개의 텔로미어가 모이는 현상인 텔로미어 클러스터링을 유발하였는데, 이것은 액체-액체 상분리 현상 (liquid-liquid phase separation, LLPS) 이었으며, 이러한 텔로미어 상분리 현상이 텔로미어 합성 및 암발생의 핵심이었다. 특히, 텔로미어 상분리는 수많은 단백질과 DNA, RNA의 밀집된 네트워크로 구성되어있는데, 상분리를 유도하는 핵심 이자가 TERRA-R-loop의 DNA:RNA혼성체임을 밝혔다. TERRA-R-loop을 제거하면 텔로미어 상분리가 사라지고 ALT 암세포의 생존 또한 막음으로써, ALT 암치료의 가능성을 제시하였다.
또한, BRCA2 돌연변이를 가진 유방암 환자 조직 샘플에서도 이러한 텔로미어 상분리 현상이 발견되었으며 그 비율이 거의 50%에 이르러 BRCA2 돌연변이 암의 치료 전략을 수립할 때 텔로미어 상분리 존재 여부를 판단하여 맞춤 항암 치료 전략을 구사할 수 있음을 제안하였다.
연구진은 성장하는 세포의 DNA 복제시 텔로미어가 역동적인 네가닥 G4 구조를 형성하며, G4의 역동성 조절이 텔로미어 항상성을 유지하는데 핵심적임을 처음으로 보인 바 있다 (Nature Communications, 2022). 이 논문은 텔로미어 G4의 역동성이 깨졌을 때 (BRCA2 결손 등) ALT암이 발생한다는 점을 처음으로 제시한다. 특히, 텔로미어 상분리 형성에 있어 텔로미어의 구조적 변화가 그 원인이 되어 재조합을 유도한다는 사실을 분자 수준에서 밝힌 점은 이 연구 결과가 BRCA2 변이 암의 발생 기전을 설명하는 것을 넘어 노화 관련 질환 등 텔로미어 복제 문제와 연관된 질환들의 발병 기전을 이해하고 새로운 치료 전략을 제시할 수 있음을 시사한다.
[본문]
서울대학교 생명과학부 이현숙 교수 연구팀은 BRCA2 암억제인자 결손으로 인한 텔로미어 구조적 손상이 텔로미어 상분리현상을 일으키는 분자적 메커니즘을 최초로 규명하였다.
염색체 말단에 존재하는 텔로미어는 세포 분열의 횟수를 제한하여 DNA 돌연변이가 축적되기 전에 세포사멸을 유도하며, 암세포로의 발달을 억제한다. 따라서 텔로미어의 항상성 유지는 유전체 안정성에 중요하며, 텔로미어의 손상은 노화 및 암 등 각종 질병의 원인이 된다.
암억제인자 BRCA2의 돌연변이는 가족력이 있는 유방암, 난소암, 췌장암 등의 조기 발병의 원인이다. 그러나 역설적이게도 BRCA2가 결핍된 세포는 텔로미어 네가닥 특이 구조 G-quadruplex (G4)가 비정상적으로 증가하여 심각한 텔로미어 손상과 세포노화로 이어진다. 이현숙 교수 연구팀은 일부 세포에서 짧아진 텔로미어를 극복하고 어떻게 암으로 발생하는지 질문하였다.
연구팀은 BRCA2 결핍으로 인해 비정상적으로 안정화된 텔로미어 G4 구조가 전사-복제 충돌을 일으켜 DNA:RNA 복합체인 R-loop 구조를 유발하는 것을 밝혔다. 특히 텔로미어가 짧은 세포에서 이러한 R-loop 구조가 많이 축적됨을 확인하여 텔로미어 핵산 구조가 암발생의 중요 인자임을 밝혔다.
R-loop 구조가 축적된 텔로미어는 두세 개가 모이는 텔로미어 클러스터링 현상을 보였는데 생물리학적으로 분석한 결과 이는 액체-액체 상분리 현상 (liquid-liquid phase separation)이었다. 텔로미어 상분리는 텔로미어 연장과 암세포의 증식에 필수적이었으며, 이러한 상분리는 단백질-핵산의 밀집된 네트워크로 이루어져 하나의 요소라도 없으면 상분리가 해체되고 나아가 암세포의 사멸로 이어짐을 밝혔다.
BRCA2 돌연변이를 가진 유방암 환자 조직샘플에서도 텔로미어 상분리를 확인할 수 있었으며, 그 빈도가 거의 50%이었다. 이번 연구는 텔로미어 구조적 손상이 어떻게 암을 개시하는지 생물물리화학적으로 접근하여 풀어냈으며, 상분리 특성을 활용하여 항암 치료의 새로운 전략을 제시하였다. 이러한 결과는 암 뿐만아니라 다양한 텔로미어 이상 관련 질환 연구에 크게 기여할 것으로 기대된다.
해당 연구 결과는 세계적인 학술지인 Nucleic Acids Research에 개제된다. 본 연구는 과학기술정보통신부 선도연구센터지원사업과 3D생체조직기반약물평가시스템개발의 지원을 받아 수행되었다.
[그림설명]
[연구결과]
Disruption of G-quadruplex dynamicity by BRCA2 abrogation instigates Phase separation and Break-induced Replication at telomeres
Jennifer J. Lee, Hyungmin Kim, Haemin Park, UkJin Lee, Chaelim Kim, Min Lee, Yongdae Shin, Ji-Jung Jung, Han-Byoel Lee, Wonshik Han, and Hyunsook Lee
(Nucleic Acids Research, https://doi.org/10.1093/nar/gkae251)
BRCA2 암억제인자 돌연변이는 유방암, 난소암의 조기 발병의 원인이다. BRCA2 변이로 인한 텔로미어 구조적 손상이 어떻게 암을 유발하는지 분자적 메커니즘을 질문하였다. 이 논문은 비정상적인 텔로미어 G4 구조가 텔로미어 상분리를 일으키고, 이러한 밀집된 단백질-핵산 네트워크가 텔로미어 합성에 핵심임을 처음으로 밝힌다.
[용어설명]
- ○물과 기름이 서로 나뉘어 두 액체상으로 존재하는 것처럼 분자별로 농도가 다른 두 영역이 공간상에 생성되는 것이다. 특히, 세포 내에서 막이 없는 세포소기관의 생성 기작으로 알려져 있다. 물리적인 막이 없음에도 특정 분자들이 한 곳에 모여있을 수 있고, 동시에 그 분자들이 세포소기관의 안팎을 자유롭게 이동할 수 있다.
- ○텔로미어에서 전사되어 UUAGGG 반복서열을 가진 RNA이다. RNA 중합효소 2에 의해 전사되며, 서브텔로미어 지역에 프로모터가 존재한다. 주로 짧은 텔로미어나 손상된 텔로미어, 혹은 ALT 암세포의 텔로미어에서 TERRA RNA가 많이 생산된다고 알려져 있다.
- ○전사 과정에서 만들어진 RNA가 DNA 이중나선의 한가닥과 결합하고 나머지 한가닥은 단일 나선 형태로 존재하는 DNA-RNA 3중 구조이다. 이전에는 DNA 손상을 야기하는 나쁜 구조로 이해했으나 최근에는 R-loop 구조가 유전자 발현 등을 조절하는 중요한 역할을 수행한다는 것이 알려졌다. 텔로미어에서는 G-quadruplex 구조와 밀접한 상관관계가 있다는 것이 보고되었다.
- ○구아닌 (G)가 반복되는 서열에서 구아닌의 화학적 성질로 인해 훅스틴 결합 (Hoogsteen bond)이 생겨 네 가닥의 판 구조 (G-quartet)를 형성한다. 이러한 판이 3개 이상 형성되면 이차구조를 형성하여 G-quadruplex 구조를 이룬다. DNA 복제 시 단일가닥으로 풀린 텔로미어에서 G4 구조가 형성될 수 있다.
- ○약 15%의 암에서는 텔로머레이즈가 발현되지 않는다. 이러한 암세포들은 DNA 재조합 방식으로 텔로미어의 길이를 유지하는데 이것이 대안적 텔로미어 유지 기작이다. 주로 중간엽 유래 암종에서 많은 비율로 보고된다. 단일 기작이 아닌 세포마다 의존적인 DNA 복구 기작을 활용하기 때문에 타겟이 어렵고 예후가 좋지 않다.
- ○DNA 이중나선 절단에 대한 복구 기작 중 하나로 특히 텔로미어 같은 단일 종단의 절단 상황에서 서열이 비슷한 가닥을 찾아 재조합으로 복구하는 방식이다. 상동재조합 (homologous recombination) 보다 상동성이 낮은 주형을 인식하여 오류가 많은 수선기작이며 보존적 복제기작이다. 주로 세포주기 중 G2, M기에서 DNA를 복구한다.

